Quels examens ?
La première étape consiste en un examen visuel complet de l'ensemble de la peau, du cuir chevelu et des muqueuses, afin de rechercher d'autres lésions suspectes. Elle inclut également la palpation des aires ganglionnaires pour détecter la présence de ganglions palpables.
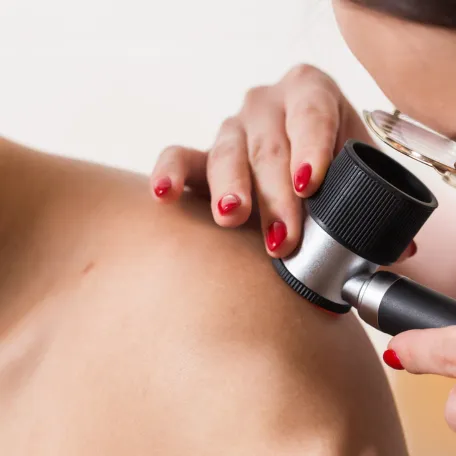
Pour aider au diagnostic des lésions pigmentées suspectes, des techniques d’imagerie cutanée, comme la dermoscopie et la microscopie confocale, apportent une aide précieuse avant le retrait chirurgical de la lésion (l’exérèse).
- La dermoscopie est une méthode non invasive qui utilise un appareil appelé dermatoscope pour examiner la peau en grossissant la lésion et en éliminant les reflets de surface. Elle permet de visualiser des structures invisibles à l’œil nu, comme les motifs pigmentaires ou les vaisseaux sanguins, et améliore ainsi la distinction entre lésions bénignes et suspectes.
- La microscopie confocale est une technique plus avancée qui permet d’observer la peau avec une résolution quasi microscopique, jusqu’aux couches profondes de l’épiderme, sans avoir besoin de retirer chirurgicalement la lésion. Elle est particulièrement utile pour les zones sensibles (visage, muqueuses) ou dans les cas où une biopsie est difficile, en fournissant des images proches de celles de l’histologie classique.
L’exérèse complète de la lésion suspecte permet une analyse au microscope (anatomopathologie) pour confirmer le diagnostic. Cette analyse permet de déterminer différents facteurs clés afin d’établir le stade du mélanome et de guider la prise en charge thérapeutique. Parmi ces facteurs, on retrouve l'épaisseur du mélanome (indice de Breslow), la présence d’une ulcération et de mitoses.
En fonction de l'examen clinique (présence ou non de ganglions palpables) et du stade du mélanome, d'autres examens pourront être demandés, tels que l'échographie des aires ganglionnaires de drainage, le scanner thoraco-abdomino-pelvien, le TEP scan, l'imagerie cérébrale, etc.
Les stades du mélanome
Critères permettant de définir le stade du mélanome
L'indice de Breslow mesure l'épaisseur du mélanome, c’est-à-dire la distance entre la surface de la peau et la couche la plus profonde de la tumeur. Plus cet indice est élevé, plus le mélanome est considéré comme grave et à risque de se propager. L’indice de Breslow est un des principaux facteurs utilisés pour définir le stade du mélanome.
Indice de Clark
Bien que l'indice de Clark ne soit plus utilisé pour définir les stades du mélanome dans les classifications récentes, il peut encore être précisé lors de l’analyse histologique. Cet indice évalue la profondeur de l'invasion tumorale dans les différentes couches de la peau (de l’épiderme jusqu’au derme profond).
Présence d'ulcération
Le terme ulcération signifie que l’épiderme (la couche la plus externe de la peau), qui recouvre la tumeur primaire n’est plus uniforme, quand elle est observée au microscope. Une ulcération n’est pas visible à l’œil nu. Les tumeurs ulcérées présentent un risque plus élevé d’être métastasiques que les tumeurs non ulcérées.
Présence de mitoses
C’est le nombre de cellules cancéreuses visibles en train de se diviser au sein de la lésion retirée chirurgicalement, lorsqu’elle est examinée au microscope. Dans le cadre du mélanome, un nombre élevé de mitoses dans la lésion suggère un pronostic moins favorable, car le mélanome à plus de risque de se propager.
Micrométastases ganglionnaires
Les micrométastases ganglionnaires font référence à de petites métastases détectées au microscope dans les ganglions lymphatiques. Elles ne sont pas visibles à l'examen clinique, mais leur présence est un signe que le cancer a commencé à se propager au-delà de la lésion primaire, ce qui affecte le stade du mélanome et influence le traitement à suivre.
Macrométastases ganglionnaires
Les macrométastases ganglionnaires sont des métastases suffisamment grandes pour être détectées à l'examen clinique (ganglions palpables), à l'échographie, ou parfois visibles à l'œil nu par le chirurgien. Leur présence signifie que le mélanome s’est propagé de manière plus significative dans les ganglions lymphatiques. Cette propagation influence directement le stade du mélanome.
Présence de métastases en transit
Les métastases en transit sont des métastases qui se trouvent entre la tumeur primaire et les ganglions lymphatiques, à une distance de plus de 2 cm de la tumeur d'origine. Elles ne sont pas encore dans les ganglions lymphatiques, mais leur présence dans cette zone de transit est un signe que le cancer pourrait se propager davantage.
Présence de métastases à distance
Les métastases à distance désignent la propagation du mélanome à d'autres organes du corps, loin du site de la tumeur initiale. Cela peut inclure des métastases dans les poumons, le foie, les os, ou d'autres tissus. La présence de métastases à distance signifie que le mélanome est à un stade avancé (stade IV).
D’autres facteurs peuvent être évalués, car ils peuvent influencer la prise en charge thérapeutique :
Détection de mutation du gène BRAF
La mutation du gène BRAF est retrouvée dans environ 50 % des mélanomes. La mutation la plus fréquente est la V600E, dans laquelle un changement spécifique de base génétique conduit à la substitution d’un acide aminé (la valine remplaçant le glutamate en position 600). Cette mutation conduit à une activation constitutive de la voie des MAP kinases (ou voie ERK), qui régule la croissance, la division et la survie des cellules. L’activation anormale de cette voie favorise la prolifération des cellules cancéreuses, contribuant ainsi à l’agressivité du mélanome. La présence de cette mutation peut influencer les options thérapeutiques, car il existe des traitements ciblés efficaces contre les mélanomes porteurs de cette mutation, comme les inhibiteurs de BRAF et de MEK.
Détection de mutations du gène Ckit
Les mutations du gène Ckit sont plus fréquemment observées dans les mélanomes acro-lentigineux (affectant les paumes, les plantes des pieds, et sous les ongles) ainsi que dans les mélanomes muqueux (tels que ceux des muqueuses génitales et digestives). La mutation Ckit est beaucoup moins courante dans les mélanomes cutanés classiques. Environ 10 à 20 % des mélanomes acro-lentigineux présentent une mutation Ckit, qui peut parfois être ciblée par des inhibiteurs spécifiques.
Détection de mutations du gène NRAS
Les mutations du gène NRAS surviennent dans environ 15 à 20 % des mélanomes cutanés, principalement dans les mélanomes non lentigineux. La mutation NRAS active également la voie MAPK, mais d'une manière différente de la mutation BRAF. Les thérapies ciblées pour les mutations NRAS sont encore en cours de développement.
Les stades du mélanomes
Stade 0 (mélanome in situ) :
Le mélanome est localisé à la surface de la peau, dans sa couche la plus superficielle (intra-épidermique) uniquement. Il n'a pas encore pénétré les couches profondes de la peau.
Stade I (mélanome localisé) :
À ce stade, le mélanome commence à pénétrer les couches plus profondes de la peau, mais reste peu épais. Il est encore localisé, sans propagation vers d'autres parties du corps.
Stade II (mélanome localisé avancé) :
Le mélanome devient plus épais mais il ne s’est pas encore propagé aux ganglions lymphatiques ni à d’autres organes.
Stade III (mélanome avec atteinte des ganglions lymphatiques) :
Le mélanome s’est propagé aux ganglions lymphatiques situés près de la tumeur d’origine (la tumeur primaire). On parle alors de micrométastases ou de macrométastases ganglionnaires.
Stade IV (mélanome métastatique) :
Le mélanome s'est propagé à d'autres organes du corps, tels que les poumons, le foie, les os, ou le cerveau.
Le traitement des mélanomes
Afin de déterminer le traitement le plus adapté pour chaque patient, les décisions thérapeutiques sont discutées en Réunion de Concertation Pluridisciplinaire (RCP) pour la prise en charge des mélanomes. Lors de cette réunion, plusieurs spécialistes, tels que des dermatologues, des oncologues, des chirurgiens, des radiologues et d'autres professionnels de santé, se réunissent pour partager leur expertise et évaluer le cas de manière collective. L'objectif est de proposer un traitement personnalisé en fonction du stade du mélanome, des caractéristiques de la tumeur, des mutations génétiques éventuelles et de l'état général du patient. Ce processus garantit que chaque patient bénéficie des meilleurs soins, validés par une équipe pluridisciplinaire avant de débuter tout traitement.
Le traitement des mélanomes localisés (du mélanomes in situ au mélanome de stade IIC)
Exérèse chirurgicale et chirurgie de reprise avec marges de sécurité
Le traitement des mélanomes localisés repose principalement sur l’exérèse chirurgicale de la lésion. Après cette première intervention, qui permet d’établir le diagnostic et d’évaluer les principaux critères pronostiques, une seconde intervention, appelée chirurgie de reprise, est réalisée. Elle consiste à retirer une zone de peau saine autour de la cicatrice initiale : c’est ce qu’on appelle la marge de sécurité, dont la largeur varie de 0,5 à 2 centimètres selon l’indice de Breslow (épaisseur du mélanome).
Technique du ganglion sentinelle
Lorsque le mélanome a une épaisseur supérieure à 0,8 mm et/ou présente une ulcération, on peut proposer une technique appelée « ganglion sentinelle ». Elle permet de savoir si des cellules cancéreuses ont commencé à se propager vers les ganglions lymphatiques. Le ganglion sentinelle est le premier à recevoir la lymphe provenant du site de la tumeur. Pour l’identifier, on injecte un colorant ou un traceur radioactif autour de la tumeur. Ce produit migre vers le ganglion sentinelle, que l’on repère à l’aide d’une caméra ou d’un détecteur. Le ganglion est ensuite retiré et analysé au microscope.
S’il est indemne, cela signifie généralement que le cancer ne s’est pas propagé. En revanche, s’il contient des cellules cancéreuses, cela indique un risque de dissémination vers d’autres ganglions.
Génotypage
Pour les mélanomes épais (à partir du stade IIB) ou en cas d’atteinte ganglionnaire, notamment si le ganglion sentinelle est positif, une analyse moléculaire de la tumeur est réalisée : c’est le génotypage. Il permet de rechercher certaines mutations fréquentes, comme celles des gènes BRAF, NRAS ou C-KIT. Ces résultats sont essentiels pour guider le choix de traitements ciblés.
Curage ganglionnaire
Lorsqu’un ou plusieurs ganglions sont atteints de manière visible (palpables à l’examen ou détectés à l’imagerie), un curage ganglionnaire peut être proposé. Il s’agit d’une intervention chirurgicale visant à retirer tous les ganglions d’une zone donnée pour limiter la propagation du cancer.
Dans certains cas un traitement adjuvant, c’est-à-dire réalisé après la chirurgie, peut être proposé au patient. Il a pour objectif de réduire le risque de récidive de la maladie. Ce traitement repose soit sur une thérapie ciblée (en cas de mutation BRAF), soit sur une immunothérapie (anti-PD1), et est décidé en fonction du stade du mélanome (il est envisagé à partir du stade IIB), de l’âge du patient et de ses antécédents.
Un suivi régulier des mélanome primitifs
Une fois l’exérèse élargie de la tumeur réalisée une surveillance régulière et prolongée est mise en place afin de détecter précocement un éventuel second mélanome cutané ou une récidive du mélanome initial que ce soit au niveau local ou à distance .
Le rythme de la surveillance dépend de l’épaisseur de la tumeur mesurée par l’indice de Breslow et du stade de la maladie avec un contrôle annuel pour les mélanomes in situ et une surveillance plus rapprochée pour les stades I et II avec un suivi tous les 3 à 6 mois pendant les trois premières années puis tous les 6 mois de la quatrième à la dixième année puis une fois par an à vie.
Ce suivi a plusieurs objectifs
- Dépister un second mélanome est essentiel car une personne ayant déjà eu un mélanome présente un risque accru d’en développer un autre et lors des visites de surveillance le dermatologue réalise un examen complet de la peau et peut utiliser la dermoscopie ainsi que des photographies de référence pour suivre l’évolution des grains de beauté ou détecter l’apparition de nouvelles lésions suspectes.
- Dépister des métastases du mélanome fait également partie intégrante du suivi qui comprend systématiquement un examen clinique de la peau et des aires ganglionnaires et selon l’épaisseur du mélanome évaluée par l’indice de Breslow et la présence éventuelle d’une ulcération une échographie des zones ganglionnaires peut être proposée en complément tandis qu’un scanner thoraco-abdomino-pelvien associé à une imagerie cérébrale sont recommandés tous les six mois pendant les trois premières années pour les mélanomes les plus épais afin de détecter d’éventuelles métastases à distance.
En parallèle du suivi réalisé par le dermatologue il est essentiel d’expliquer au patient comment s’auto-surveiller entre les consultations afin de repérer rapidement toute nouvelle lésion ou modification suspecte de la peau.
Le traitement des mélanomes avancés et métastatiques (stade III et IV)
La prise en charge du mélanome s’est considérablement modifiée ces dernières années avec de nouveaux traitements apportant une amélioration considérable des réponses aux stades avancés.
Plusieurs éléments sont à prendre en compte afin de déterminer le traitement le plus adapté dans ces situations.
- Le caractère résécable ou non du mélanome et de ses métastases est l’un des premiers critères à considérer. On parle de mélanome résécable lorsque la tumeur peut être complètement retirée par chirurgie, avec des marges de sécurité suffisantes. Autrement dit, le cancer est localisé ou limité à des zones accessibles, et son ablation chirurgicale est techniquement possible et potentiellement curative. De même, on considère que des métastases sont résécables lorsqu’elles peuvent être enlevées par chirurgie ou traitées par une technique permettant leur destruction, comme la radiofréquence ou la radiothérapie stéréotaxique.
- La présence d’une mutation du gène BRAF sur les métastases, ou si cela ne peut pas être établi, sur la tumeur primitive
- La présence ou non de métastases cérébrales
- L’état général du patient
L’arsenal thérapeutique comprend actuellement :
Les thérapies ciblées :
Les thérapies ciblées sont des traitements qui ciblent des mutations génétiques spécifiques présentes dans les cellules tumorales (et pas dans les cellules saines), permettant ainsi un traitement plus précis et efficace. Dans le cas du mélanome, il s'agit principalement de thérapies combinant des inhibiteurs de BRAF et des inhibiteurs de MEK, qui ne peuvent être utilisées que si une mutation du gène BRAF a été identifiée au sein de métastases ou du mélanome lui-même. Ces traitements sont généralement envisagés pour les mélanomes de stade III et IV résécables après la chirurgie, c’est-à-dire en tant que traitement adjuvant, ou pour les mélanomes non résécables. Elles sont souvent utilisées en deuxième intention, après une immunothérapie, ou lorsque l’on souhaite une réduction rapide d’une masse tumorale importante. Les thérapies ciblées sont administrées sous forme de comprimés à domicile, avec des suivis réguliers en hôpital de jour ou en consultation externe. Elles agissent très rapidement, ce qui les rend particulièrement efficaces en cas de forte masse tumorale métastatique. Cependant, un phénomène d’échappement secondaire peut survenir, c'est-à-dire que les cellules cancéreuses peuvent devenir résistantes à ces traitements au fil du temps.
L’immunothérapie
Elle permet de lever l’inhibition de la réponse immunitaire induit par le mélanome et de permettre ainsi de rétablir des moyens de défenses efficaces contre les cellules tumorales. Ces traitements sont administrés par voie intra-veineuse en hospitalisation de jour toutes les 2 à 3 semaines. Ils ont un délai d’action plus long mais permettent des réponses prolongées sur plusieurs mois voire années chez environ la moitié des patients.
Plusieurs classes sont utilisés :
- Les anti-PD1 : Ils bloquent la protéine PD-1, permettant au système immunitaire de mieux détecter et détruire les cellules cancéreuses. Il s’agit du nivolumab et du pembrolizumab.
- Les anti-CTLA-4 : Ils inhibent la protéine CTLA-4, renforçant l’activation des cellules immunitaires pour attaquer la tumeur. Il s’agit de l’ipilimumab.
- Les anti-LAG-3 : Cette classe bloque la protéine LAG-3, augmentant l’activité des cellules immunitaires contre le cancer. Il s’agit du relatlimab.
Utilisation comme traitement adjuvant : un traitement adjuvant, c’est-à-dire administré après le retrait chirurgical complet du mélanome, par anti-PD1 peut être proposé pour les mélanomes de stade III résécables (AMM du nivolumab et du pembrolizumab) ainsi que pour les mélanomes de stade IV résécables (AMM du nivolumab), généralement pour une durée d’un an.
Utilisation comme traitement néo-adjuvant : des études récentes ont montré l’intérêt d’utiliser les anti-PD1 seuls (notamment le pembrolizumab pour les stades IIIB à IV résécables), ou en association avec l’ipilimumab (en utilisant le nivolumab associé à l’ipilimumab pour les stades III résécables), avant la chirurgie, c’est-à-dire dans le cadre d’un traitement dit néoadjuvant. Cette stratégie pourrait donc être envisagée pour les mélanomes de stade IIIB à IV résécables, bien qu’il n’existe pas encore d’autorisation de mise sur le marché de ces molécules en situation néoadjuvante.
Utilisation pour les mélanomes non résécables : Dans le cas des mélanomes et/ou métastases non résécables, l’association d’un anti-PD1 et de l’ipilimumab est généralement proposée en première ligne, y compris en présence d’une mutation du gène BRAF.
Depuis 2024, l’association d’un anti-PD1 et d’un anti-LAG-3 (relatlimab) a également obtenu une AMM pour les mélanomes avancés (non résécable ou métastatique) sans métastases cérébrales actives et présentant une expression tumorale de PD-L1
3. De nouvelles techniques de radiothérapie ciblée dite « stéréotaxique » sont également développées, notamment pour traiter des métastases uniques ou peu nombreuses, localisées dans le cerveau, les poumons, le foie ou les os. Cette radiothérapie de haute précision permet de délivrer une dose élevée directement sur la lésion tout en préservant les tissus sains environnants. Elle peut être utilisée seule ou en complément d’un traitement systémique.
4. La radiofréquence est une technique qui consiste à introduire une aiguille directement dans la métastase, sous guidage scanner, et à y appliquer une chaleur intense par des ondes de haute fréquence pour détruire localement les cellules tumorales. Elle peut être envisagée pour certaines métastases accessibles, notamment hépatiques ou pulmonaires, lorsqu’elles sont peu nombreuses et bien localisées.
La prise en charge des formes métastatiques doit être réalisée ou au moins décidée dans un centre expert à la fois pour le choix thérapeutique avec souvent des combinaisons ou des séquences de traitements, mais aussi pour anticiper et contrôler de possibles effets secondaires de ces traitements par immunothérapie, effets indésirables nécessitant une gestion multidisciplinaires.
Un suivi rapproché des mélanomes métastatiques
Au stade métastatique les patients sont suivis très régulièrement en milieu hospitalier selon le traitement en cours et le type de métastase, scanner, irm voire pet-scanner tous les 2 à 3 mois.