info Résumé
L’hidradénite suppurée (HS) ou maladie de Verneuil est une dermatose inflammatoire chronique.
Les critères diagnostiques associent :
- La présence de lésions typiques c'est-à-dire des nodules profonds douloureux ou abcédés, des trajets fistuleux, des cicatrices fibreuses en pont et des comédons ouverts ;
- Une localisation typique (atteinte des régions axillaires, mammaires, inguinales, périnéo-fessière) ou atypique (visage, cou, cuir chevelu…)
- Des lésions chroniques et récurrentes.
Aucun examen complémentaire n’est utile au diagnostic.
Malgré ces critères bien établis, le délai diagnostique moyen est encore trop long, de l’ordre de 8 ans.
Toute lésion nodulaire, tout abcès situé dans les régions axillaires, inguinales, périnéales ou mammaires, doit faire évoquer le diagnostic de maladie de Verneuil, et ceci d’autant plus en cas de deux épisodes sur une période 6 mois.
La fréquence dans la population française générale est de l’ordre de 1% avec 3 femmes atteintes pour 1 homme atteint environ.
Le tabagisme et le surpoids sont significativement associés à l’hidradénite suppurée.
I. L’hidradénite suppurée, à quoi ça ressemble ?
Comprendre
L’hidradénite suppurée, également appelée maladie de Verneuil, est une maladie inflammatoire chronique de la peau.
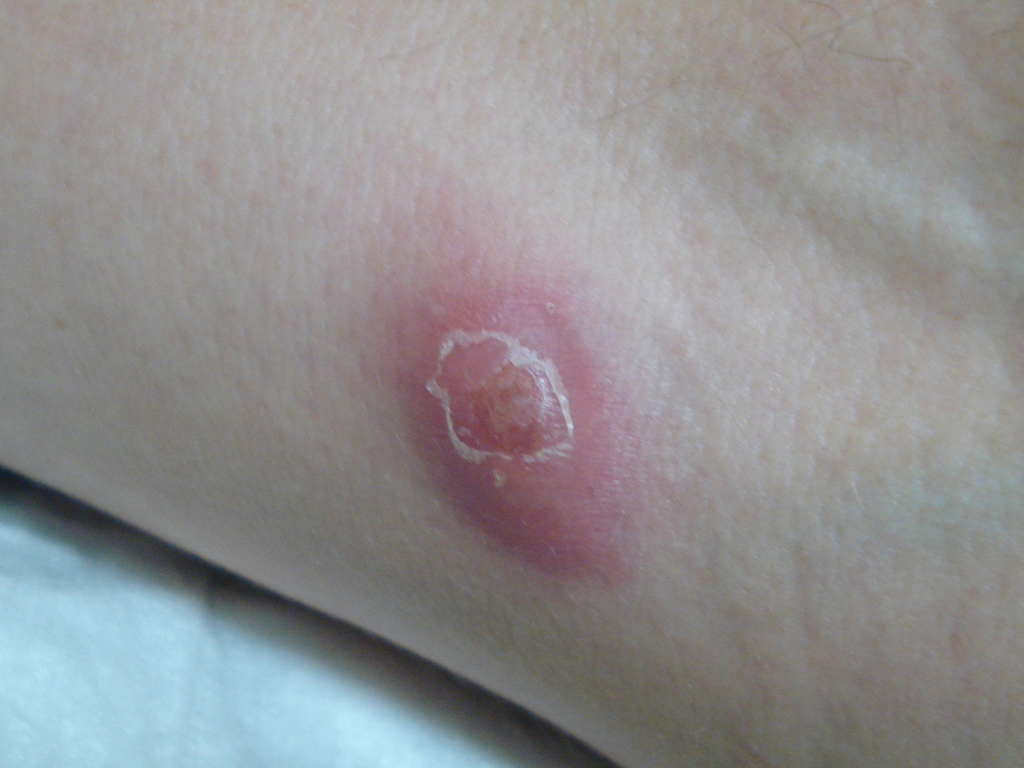
Les lésions précoces sont des nodules douloureux isolés pouvant s’abcéder et persister plusieurs semaines.
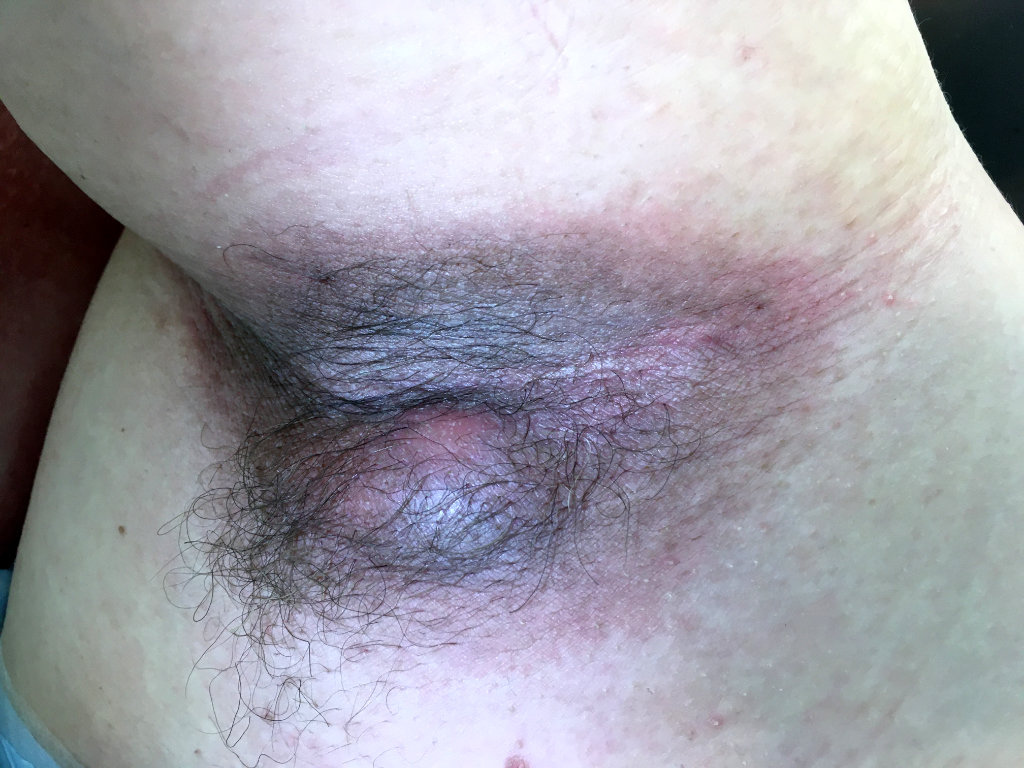
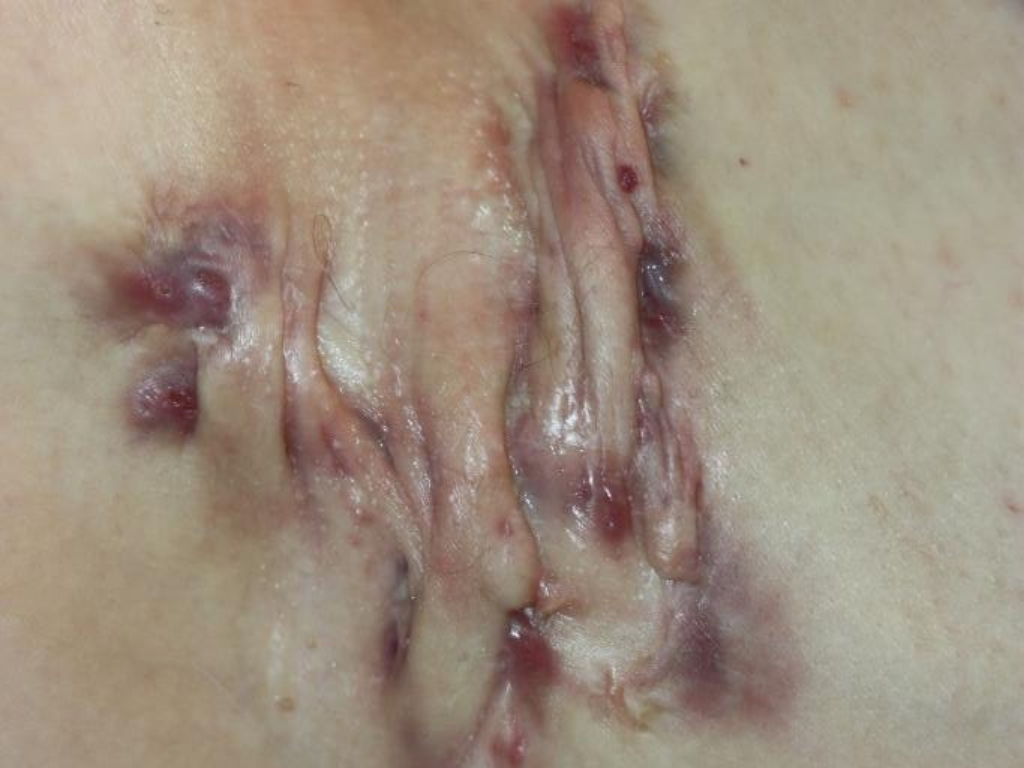
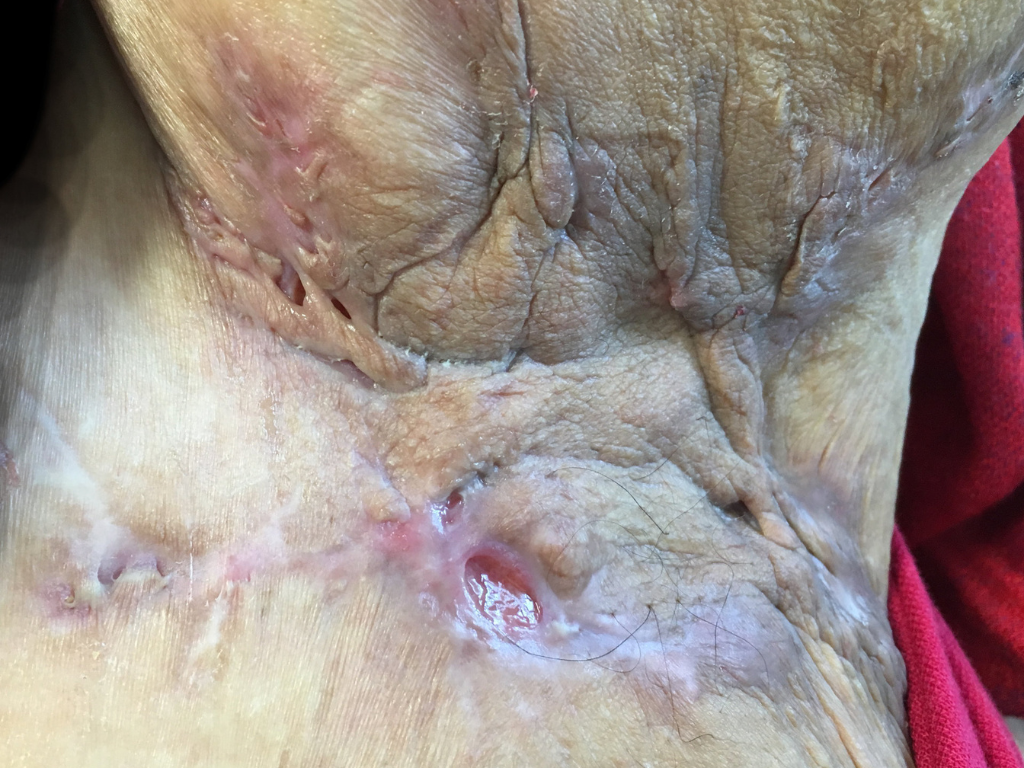
Les poussées inflammatoires répétées entraînent progressivement la formation de cicatrices épaisses et dures appelées cicatrices en pont. On observe également la création de trajets fistuleux, c’est-à-dire de tunnels qui se forment sous la peau et relient entre elles différentes lésions ou débouchent à la surface de la peau. Des comédons ouverts (points noirs) peuvent aussi apparaître. Des lésions atypiques peuvent aussi être présentes (folliculite, bourgeons charnus, cicatrices vermoulues, cicatrices à l’emporte-pièce, kystes épidermiques).
Il n’y a généralement ni fièvre ni ganglions (adénopathies) associés. Les infections par des bactéries pyogènes sont exceptionnelles.
Localisations
Elle survient principalement dans les zones de plis du corps.
Les zones les plus souvent atteintes sont les régions axillaires (aisselles), inguinales (plis de l’aine), périnéales, fessières et mammaires (sous les seins). D’autres localisations sont toutefois possibles, notamment le visage, la nuque ou le dos.
La présence de lésions faciales notamment pré- ou rétro-auriculaires, mandibulaires doit faire évoquer un diagnostic d’HS faciale.
Présentation clinique
La présentation clinique de la maladie peut varier considérablement d’une personne à l’autre, en fonction des zones atteintes, du type de lésions, de leur évolution et de leur sévérité. Des différences selon le sexe ont été observées : les femmes sont plus souvent touchées au niveau des zones antérieures, comme les aisselles et les seins, tandis que chez les hommes, les atteintes fessières ou situées dans des zones moins habituelles semblent plus fréquentes.
Une étude de classe latente a permis d’identifier trois profils d’atteinte distincts.
- La première forme, dite axillo-mammaire, représente environ 48 % des cas. Elle est caractérisée par des atteintes situées préférentiellement au niveau des aisselles et des seins, avec des lésions de type nodulaire et des cicatrices en pont. Cette forme typique concerne surtout des femmes en surpoids.
- La deuxième forme, dite folliculaire, représente environ 26 % des cas. Elle est marquée par une atteinte plus diffuse : aisselles, thorax, dos, membres, et régions rétro-auriculaires. Elle se caractérise par une forte probabilité de lésions folliculaires, telles que des kystes épidermiques, des comédons ou un sinus pilonidal. Cette forme, souvent plus sévère, est plus fréquemment observée chez des hommes fumeurs.
- La troisième forme, dite fessière, représente également 26 % des cas. Elle se manifeste par une atteinte localisée aux fesses, sous forme de papules et de folliculites.
Ces formes cliniques pourraient refléter des mécanismes physiopathologiques différents dans le développement de la maladie.
Des formes cliniques particulières existent (classification de Van der Zee et coll.)1 :
- Type furoncules par friction : Lésions qui ressemblent à des furoncles et apparaissent dans les zones de frottement des vêtements ou entre les plis de peau.
- Type folliculite cicatricielle : Inflammation des follicules pileux qui laisse des marques et cicatrices permanentes sur la peau.
- Type conglobata : Forme sévère associant kystes et acné importante au visage et dans le dos. Elle touche plutôt des patients de poids normal, souvent fumeurs, avec des antécédents familiaux de la maladie.
- Type ectopique : Forme inhabituelle où les lésions apparaissent sur des zones normalement épargnée par cette maladie.
- Type syndromique : Forme associée à d'autres maladies inflammatoires comme l'acné sévère, la maladie de Crohn ou certaines arthrites.
II. Physiopathologie de l’hidradénite suppurée
La physiopathologie de l’hidradénite suppurée est complexe. Plusieurs mécanismes sont suspectés de contribuer à son développement. Il ne s’agit pas d’une seule cause, mais plutôt d’un ensemble de facteurs combinés.
1. Maladie du follicule pileux :
Les lésions apparaissent souvent dans des zones riches en glandes sudorales (les glandes sudorales apocrines), comme les aisselles ou l’aine. Cela, ainsi que le lien avec d’autres maladies touchant les follicules pileux, suggère que la maladie commence par un dysfonctionnement du follicule regroupant ces structures (le follicule pilo-sébacéo-apocrine). Ce serait son obstruction précoce qui déclencherait l’inflammation. Les glandes sudorales ne seraient touchées qu’ensuite, de manière secondaire.
2. Role de la flore cutanée :
L’HS n’est pas une maladie infectieuse au sens classique du terme, car aucun micro-organisme spécifique n’a été identifié comme agent responsable. Cependant, des études ont mis en évidence une altération de la flore cutané, appelée dysbiose. Cette dysbiose varie selon la sévérité de la maladie. Par ailleurs, l’amélioration des symptômes chez certains patients sous antibiothérapie renforce l’idée que la flore cutanée joue un rôle important.
3. Facteurs hormonaux :
De nombreuses femmes rapportent une aggravation des poussées juste avant les règles, ainsi qu’une amélioration pendant la grossesse ou après la ménopause. Certaines pathologies hormonales, comme le syndrome des ovaires polykystiques ou l’excès d’androgènes (hormones mâles), sont aussi plus fréquentes chez les patientes atteintes.
4. Susceptibilité génétique :
On estime que 30 à 40 % des patients ont des antécédents familiaux d’hidradénite suppurée. Des mutations affectant les gènes codant pour la γ-sécrétase ont été identifiées chez plusieurs personnes atteintes, notamment dans des formes familiales. Ce complexe enzymatique intervient dans le bon fonctionnement de la voie de signalisation NOTCH, essentielle pour la régulation de l’activité des follicules pileux et des glandes sudorales. Une altération de cette voie perturberait donc le fonctionnement normal de ces structures, favorisant le développement de la maladie.
5. Anomalie de la réponse immunitaire :
L’efficacité des antibiotiques et de traitements immunosuppresseurs laisse penser que le système immunitaire (système de défense de l’organisme) réagit de manière excessive à la flore microbienne naturellement présente sur la peau dans l’HS. Les mécanismes immunitaire semblent ainsi déréglés et lorsque le follicule pilo-sébacé se bouche et se rompt, cela déclenche une réaction inflammatoire trop intense, libérant des substances inflammatoires comme les interleukines IL-17A et IL-17F.
6. Rôle du tabac et du cannabis :
Le tabagisme apparaît comme un facteur déclenchant et aggravant bien établi. De nombreuses études rapportent un tabagisme actif chez les patients atteints d’hidradénite suppurée, parfois jusqu’à 90 % des patients atteints. Certains d’entre eux observent une nette aggravation de leur maladie lorsqu’ils augmentent leur consommation de tabac, et une amélioration après son arrêt. Le mécanisme précis reste incertain, mais la nicotine pourrait modifier le fonctionnement des glandes sudorales en stimulant d’abord leur sécrétion, puis en perturbant leur fonctionnement, ce qui favoriserait l’obstruction et l’inflammation.
7. Surpoids et syndrome métabolique :
Le surpoids et le syndrome métabolique sont aussi des facteurs fréquemment associés à l’HS. Ce syndrome, qui regroupe plusieurs troubles métaboliques comme l’obésité, l’hypertension artérielle, un taux élevé de sucre dans le sang et des anomalies lipidiques, est retrouvé chez 30 à 50 % des patients ayant une HS. L’obésité augmente non seulement la fréquence et la sévérité des poussées, mais aussi le risque de récidive après traitement. Une perte de poids significative améliore souvent les symptômes. Les mécanismes en jeu incluent l’inflammation chronique associée à l’obésité, les frottements mécaniques qui favorisent la rupture des follicules, ainsi que l’augmentation de la chaleur et de l’humidité dans les plis cutanés, ce qui perturbe l’équilibre de la flore cutanée.
III. Autour de la maladie
Fréquence de la maladie
Sa prévalence, c’est-à-dire la proportion de personnes touchées dans la population, varie selon les études entre 0,05 % et 4,1 %.
Évolution
Elle débute en général chez l’adulte jeune, autour de 22 ans en moyenne. La maladie peut rester active pendant près de 20 ans. Chez les femmes, elle tend à s’atténuer après la ménopause, et des périodes de rémission sont parfois observées pendant la grossesse.
Scores
La classification de Hurley cote la sévérité de la maladie en 3 groupes (c’est un score statique) :
| Grade I | Grade II | Grade III |
| Abcès unique ou multiples sans fistule, ni processus cicatriciel fibreux. | Abcès récidivants avec formation de fistules et de cicatrices hypertrophiques. Lésions unique ou multiples séparées les unes des autres. | Atteinte diffuse, ou fistules interconnectées et abcès sur toute l’étendue de la zone atteinte. |
Dans une étude française menée sur 302 patients, environ deux tiers étaient classés au stade I, correspondant à une forme légère. Un peu moins d’un tiers étaient au stade II, forme modérée. Moins de 5 % présentaient une forme sévère, correspondant au stade III.
Pour une évaluation plus précise et dynamique de l’évolution de la maladie, un autre outil est utilisé : le score IHS4 (International Hidradenitis Suppurativa Severity Scoring System). Il prend en compte le nombre de nodules inflammatoires, d’abcès et de tunnels drainants présents lors de la consultation. En fonction du score obtenu, la maladie est classée comme légère (score ≤ 3), modérée (score entre 4 et 10) ou sévère (score ≥ 11).
D’autres systèmes d’évaluation sont parfois utilisés, comme le score de Sartorius modifié ou l’échelle d’évaluation globale par le médecin (PGA).
Enfin, l’impact de la maladie sur le quotidien est évalué à l’aide du Dermatology Life Quality Index (DLQI), un questionnaire qui mesure combien la maladie altère la qualité de vie. Le suivi peut aussi inclure une évaluation de la douleur et de l’écoulement des lésions grâce à une échelle visuelle (EVA), ce qui permet d’adapter le traitement en fonction des symptômes les plus gênants pour le patient.
IV. Complications
L’hidradénite suppurée a un impact important sur la vie quotidienne, à la fois sur le plan social, professionnel et psychologique. Parmi les maladies de peau, elle fait partie de celles qui altèrent le plus la qualité de vie.
Les douleurs, les écoulements chroniques, les odeurs et les cicatrices peuvent entraîner une gêne marquée dans les relations personnelles, affectives ou au travail. Les personnes atteintes rapportent souvent une baisse de l’estime de soi, un sentiment de rejet ou de stigmatisation, et parfois un isolement. Le risque de troubles anxieux et de dépression est plus élevé chez ces patients.
L’inflammation chronique et répétée peut aussi entraîner un lymphœdème, c’est-à-dire un gonflement provoqué par un mauvais drainage de la lymphe. Ce phénomène peut toucher différentes zones du corps, en fonction des localisations atteintes.
Dans de rares cas, des lésions cancéreuses de type carcinomes épidermoïdes ont été observées après une évolution très prolongée de la maladie, en général au-delà de dix à vingt ans. Ces cas concernent surtout des hommes, avec des atteintes fessières.
V. Maladies associées
L’hidradénite suppurée peut être associée à d’autres maladies qui touchent également les follicules pileux. Parmi elles, on retrouve les folliculites, le sinus pilonidal, la folliculite disséquante du cuir chevelu. Le lien avec certaines formes d’acné, notamment l’acné conglobata, est encore discuté.
La maladie de Crohn représente à la fois une pathologie à différencier de l’hidradénite suppurée, en particulier dans ses formes anopérinéales, mais aussi une maladie fréquemment associée. Dans une étude portant sur 1093 patients atteints de maladie inflammatoire chronique de l’intestin, la prévalence de l’hidradénite suppurée a été estimée à 23 %.
Des atteintes articulaires inflammatoires peuvent également être présentes. Les personnes souffrant d’hidradénite suppurée présentent une fréquence plus élevée de rhumatismes inflammatoires chroniques par rapport à la population générale. Un lien particulier a été évoqué avec les spondylarthropathies, un groupe de maladies touchant la colonne vertébrale et les articulations, notamment la spondylarthrite ankylosante et le syndrome SAPHO. L’association à une spondylarthropathie a été estimée à environ 3,7 %.
De rares cas de pyoderma gangrenosum, une autre maladie inflammatoire de la peau, ont également été rapportés chez des patients atteints d’hidradénite suppurée. Dans certains cas exceptionnels, des syndromes auto-inflammatoires peuvent aussi être associés.
Lorsqu’on considère la diversité des formes cliniques et les nombreuses maladies associées, l’hidradénite suppurée peut être vue non seulement comme une maladie de la peau, mais comme un véritable syndrome regroupant plusieurs atteintes.
VI. Examens complémentaires
Le diagnostic de l’hidradénite suppurée repose sur l’examen clinique, c’est-à-dire l’observation directe des lésions par le médecin. Aucun examen complémentaire n’est nécessaire de manière systématique.
Certains examens peuvent être prescrits dans des situations particulières, par exemple en cas de surinfection ou avant la mise en place de certains traitements.
Par ailleurs, il est parfois recommandé de réaliser un bilan une fois par an afin de dépister d’éventuelles maladies associées, en particulier un diabète ou des anomalies des lipides sanguins afin de mieux évaluer les facteurs de risque cardiovasculaire associés.
VII. Les traitements de l’hidradénite suppurée
À ce jour, il n’existe pas de traitements médicamenteux permettant une guérison définitive. Néanmoins, la combinaison simultanée ou successive de traitements médicaux et chirurgicaux peut améliorer les symptômes des patients.
Seul la chirurgie d’exérèse large, c’est-à-dire l’ablation complète des zones touchées, peut conduire à une guérison durable.
Il n’existe pas d’études de fort niveau de preuve permettant de guider les choix thérapeutiques. Le choix du traitement dépend du type de lésions, de leur localisation, de leur nombre et de leur gravité.
1. Mesure hygieno dietetiques
L’arrêt complet du tabac est fortement recommandé, car le tabagisme constitue un facteur aggravant de la maladie. En revanche, il ne semble pas augmenter le risque de complications post-opératoires ni retarder la cicatrisation après une chirurgie d’une HS. Le tabagisme ne doit donc pas être un frein à la prise en charge chirurgicale des patients.
Le contrôle du surpoids et du syndrome métabolique est également essentiel. Une alimentation pauvre en sucres peut aider à améliorer les symptômes. Chez certains patients, l’exclusion des produits laitiers a aussi permis une amélioration des lésions. Ces mesures doivent être adaptées individuellement, et peuvent faire l’objet d’un accompagnement nutritionnel spécialisé.
2. Le traitement médical
Les antibiotiques sont le traitement de première intention dans l’hidradénite suppurée, même si leur efficacité n’a pas été évaluée dans des études comparatives à grande échelle.
- Dans les formes légères et peu récidivantes, des traitements antibiotiques en courte cure peuvent améliorer les poussées aigues d’HS. Selon les recommandations françaises, chez les patients présentant une forme peu sévère (stade Hurley I) avec moins de 4 poussées par an, un traitement ponctuel par antibiotique (par exemple amoxicilline-acide clavulanique ou pristinamycine pendant 7 jours) peut être proposé. En cas de nodule douloureux avec abcès, une incision peut permettre de soulager rapidement la douleur, mais une intervention chirurgicale plus complexe n’est pas recommandée à ce stade.
- Dans les formes récidivant plus fréquemment ou chroniques, l’objectif est de réduire l’inflammation et la fréquence des poussées, afin de stabiliser la maladie en vue d’un éventuel traitement chirurgical. Pour les formes modérées à sévères (stades Hurley I avec au moins 4 poussées par an, ou Hurley II ou III), un traitement de fond par antibiotiques sur plusieurs mois est souvent prescrit. Il peut s’agir de doxycycline, de lymécycline ou de cotrimoxazole, avec une réévaluation généralement au bout de six mois.
- Dans les formes sévères ou très inflammatoires, des antibiothérapies à plus large spectre ou combinées peuvent être nécessaires, toujours sous surveillance médicale.
Chez certains patients, les antibiotiques n’ont pas une efficacité durable et des récidives peuvent survenir rapidement à l’arrêt des antibiotiques. Dans ce cas, il peut être nécessaire d’intensifier la prise en charge en ayant recours à des biothérapies, c’est-à-dire à des traitements ciblant des mécanismes précis de l’inflammation.
Plusieurs biothérapies ont actuellement une autorisation de mise sur le marché et un remboursement dans cette indication et peuvent donc être envisagées : il s’agit de l’adalimumab, du sécukinumab et du bimékizumab. Les recommandations européennes positionnent au même niveau ces 3 molécules en cas d’échec au traitement antibiotique.
Le choix du médicament dépendra de plusieurs facteurs : antécédents médicaux, autres maladies associées, tolérance du traitement et préférences du patient (fréquence et mode d’administration).
Adalimumab :
L’adalimumab est administré par injection sous-cutanée : 160 mg le premier jour, 80 mg au jour 15, puis un traitement d’entretien à 80 mg toutes les deux semaines ou 40 mg chaque semaine. Dans des études cliniques (PIONEER 1 et 2), entre 42 et 59 % des patients ont obtenu une réduction significative des lésions inflammatoires après 12 semaines. Si aucune amélioration n’est observée (moins de 25 %), le traitement est arrêté. Si l’amélioration est partielle (entre 25 et 50 %), une poursuite du traitement pendant 3 mois supplémentaires peut être envisagée, car certains patients répondent plus lentement. En cas de rechute, la fréquence d’injection peut être temporairement augmentée.
Sécukinumab :
Le sécukinumab est administré à la dose de 300 mg par semaine aux semaines 0, 1, 2, 3, 4, puis toutes les 4 semaines en entretien. Cette posologie peut être augmentée à une injection toutes les deux semaines selon la réponse du patient. Dans les études mesurant son efficacité (SUNRISE et SUNSHINE), environ 42 à 45 % des patients ont montré une amélioration significative (baisse de 50 % des nodules et abcès sans augmentation des fistules) à 16 semaines. L’efficacité se poursuit jusqu’à 1 an pour de nombreux patients. Les effets indésirables les plus fréquents sont les maux de tête et les infections à Candida (levures), en général bénins.
Bimékizumab :
Le bimékizumab est administré à la dose de 320 mg (en une ou deux injections sous-cutanées) toutes les 2 semaines pendant 16 semaines, puis toutes les 4 semaines en traitement d’entretien. Dans les études mesurant son efficacité (BE HEARD I et II), environ 48 à 52 % des patients ont obtenu une amélioration significative des lésions (baisse de 50 % des nodules et abcès sans augmentation des fistules) à 16 semaines.
Autres options :
Chez certains patients ne répondant pas à ces traitements, d’autres biothérapies peuvent être envisagées. L’infliximab, un autre médicament ciblé, a montré un intérêt dans des études en vie réelle, notamment à doses plus élevées administrées toutes les quatre semaines.
Enfin, de nouvelles pistes thérapeutiques sont actuellement en cours d’étude, comme les inhibiteurs des JAK (Janus kinases), qui pourraient offrir à l’avenir de nouvelles options de traitement.
3. La Chirurgie
La chirurgie est à ce jour le seul traitement curatif de l’hidradénite suppurée. Elle est particulièrement indiquée dans les formes non inflammatoires, et peut être réalisée sans interrompre une éventuelle biothérapie en cours. La chirurgie ne doit pas être considérée uniquement comme une solution de dernier recours après l’échec des traitements médicamenteux, mais comme une composante à part entière de la stratégie de prise en charge.
Le choix de l’intervention chirurgicale dépend du type de lésions présentes. En pratique, la présence de fistules implique, à court ou moyen terme, le recours à la chirurgie, souvent après un traitement médical préalable. L’intervention peut être localisée ou plus étendue selon l’atteinte.
On distingue deux grands types d’intervention :
La chirurgie en urgence
Elle consiste à drainer un nodule abcédé ou un abcès afin d’agir rapidement sur la douleur mais si possible sans incision. Une injection intra lésionnelle de corticoïdes retards peut être associée avec des résultats intéressants. On évitera autant que possible les chirurgies plus invasives (mise à plat chirurgicale ou une chirurgie localisée) en situation d’urgence
La chirurgie programmée
Elle est indiquée en présence de fistules, incluant le sinus pilonidal. Elle peut consister en une exérèse localisée, une marsupialisation ou deroofing, ou une chirurgie large excisant les zones touchées au-delà des follicules pileux.
L’étendue de l’intervention dépend du caractère localisé ou diffus des lésions. Cette chirurgie nécessite une bonne coordination entre les équipes médicales et chirurgicales, et doit idéalement être menée par des praticiens expérimentés. Elle est généralement planifiée après un traitement médical prolongé, souvent à base d’antibiotiques ou de biothérapies, afin de réduire l’inflammation avant l’opération.
Technique de marsupialisation (ou « deroofing »)
Cette méthode consiste à ouvrir les fistules à l’aide d’un bistouri, d’un bistouri électrique (technique STEEP) ou d’un laser CO2, en suivant leur trajet avec un stylet. Réalisable sous anesthésie locale, elle est adaptée aux formes peu étendues. Elle est aussi préconisée selon l’expérience des auteurs pour les formes superficielles atypiques situées hors des plis et résistantes aux traitements médicaux.
Les suites opératoires sont en général simples, avec une cicatrisation en deux à trois semaines.
Exérèse chirurgicale large
Ce type de chirurgie est le traitement de référence pour les formes les plus avancées de la maladie, en particulier les formes dites Hurley stade 3. Ces formes se caractérisent par une importante zone cicatricielle, souvent épaisse et étendue. L’intervention consiste à retirer en une seule fois tous les tissus atteints, en allant parfois en profondeur sous la peau, selon l’ampleur des lésions. Une IRM peut être réalisée avant l’opération pour repérer les zones atteintes en profondeur et mieux planifier la chirurgie.
Cicatrisation dirigée
Dans les zones de pli (comme les aisselles ou l’aine), on privilégie une méthode de cicatrisation appelée « dirigée ». Elle permet à la peau de se réparer naturellement en formant progressivement un nouveau tissu sain. La fermeture complète de la plaie prend généralement entre 6 et 8 semaines. Si la peau se rétracte trop pendant la cicatrisation, une petite greffe de peau peut parfois être nécessaire. Cette méthode présente l’avantage de limiter les cicatrices supplémentaires.
Ces exérèses larges permettent d’améliorer significativement la qualité de vie de 70% des patients qui sont le plus souvent satisfaits des résultats cosmétiques.
4. Les Lasers
L’épilation au laser (Nd-YAG long pulse à privilégier) est possible et conseillée pour les formes débutantes de maladie de Verneuil notamment quand il existe une folliculite superficielle mais le cout reste en grande partie à la charge des patients.
Ce type de laser peut aussi être utilisé dans les formes débutantes de sinus pilonidal et diminue le risque de récidive après chirurgie.
info L’hidradénite suppurée chez l’enfant et l’adolescent
L’hidradénite suppurée débute généralement à l’âge adulte, mais elle peut aussi concerner les enfants et les adolescents. Cette forme pédiatrique représente entre 2,2 % et 12,5 % des cas. Comme chez l’adulte, les filles sont plus fréquemment touchées.
Chez les jeunes patients, le risque de syndrome métabolique est significativement augmenté, jusqu’à 12 fois plus élevé que dans la population générale. On observe aussi une fréquence accrue de troubles métaboliques tels que les dyslipidémies (excès de graisses dans le sang), le prédiabète et le diabète.
La maladie a également un fort retentissement psychologique. Jusqu’à 34 % des enfants et adolescents présentent des signes d’anxiété, et jusqu’à 19 % souffrent de dépression. L’acné, en particulier l’acné conglobata, est fréquemment associée à l’HS.
Environ 5 % des jeunes patients présentent aussi une maladie inflammatoire chronique de l’intestin (MICI).
Sur le plan thérapeutique, certains traitements sont contre-indiqués chez l’enfant, comme la doxycycline avant l’âge de 8 ans. Lorsque les traitements classiques ne suffisent pas, des biothérapies peuvent être envisagées, comme chez l’adulte. À ce jour, l’adalimumab est la seule biothérapie ayant une autorisation de mise sur le marché (AMM) pour les enfants de 12 ans et plus, pesant au moins 30 kg. La chirurgie reste une option plus rarement proposée dans cette population.
info Télécharger la fiche
Sources
- Hessel H. van der Zee, Gregor B.E. Jemec, New insights into the diagnosis of hidradenitis suppurativa: Clinical presentations and phenotypes, 2015, https://doi.org/10.1016/j.jaad.2015.07.047